Valneva: Weiter SPEKULATIV HALTEN – Neue EMA-Datenforderungen noch längst nicht das EU-Aus für VLA2001
Weiterer Datenbedarf der EMA (noch) kein Rückschlag

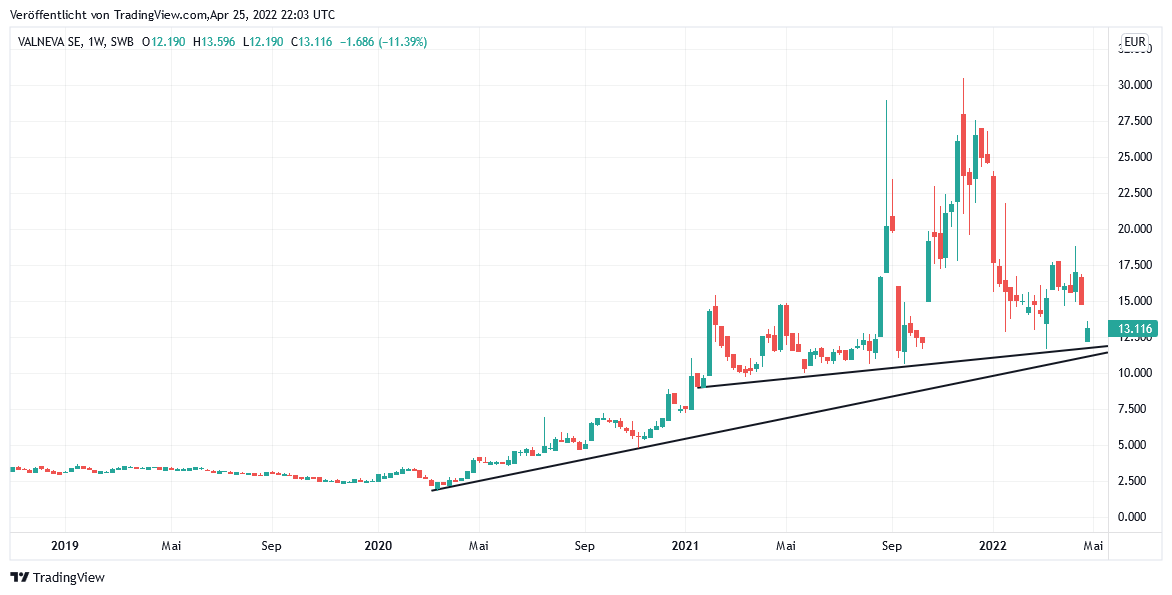
Gestern brach die Aktie von VALNEVA, dem ersten potenziellen Kandidaten für die europäische Zulassung eines Ganzkörper-Totimpfstoffs (VLA2001) gegen das Corona-Virus unter chemischer Abtötung / Deaktivierung aller relevanten S-, M- und N-Proteinstrukturen des Virus, bis zum Tradegate-Handelsschluss um - 12,0 % auf 13,12 EUR ein, nachdem das Tagestief der Aktie sogar nur bei 11,90 EUR gelegen hatte. Hintergrund dieses Kursturzes war die nach dem letzten Sitzungsabschluss der CHMP erneut erfolgte weitere Dateneinreichungsanforderung der EMA vor einer finalen Entscheidung über eine etwaige künftige bedingte EU-Zulassung von VLA2001, was uns jedoch insgesamt als kaum nachvollziehbar erscheint.
Am gestrigen Morgen publizierte VALNEVA (FR0004056851) vorbörslich die ernüchternde und von ihrem CEO Thomas Lingelbach auch mit klarer Enttäuschung kommentierte Nachricht, dass die EU-Arzneimittelbehörde EMA auf Empfehlung ihres wissenschaftlichen Zulassungsprüfungs-Organs CHMP nach Abschluss deren letzter turnusmäßiger Beratungssitzung am 22.04. sich weiterhin nicht in der Lage sähe, dem designierten Corona-Totimpfstoff-Kandidaten VLA2001 von Valneva wie vom Konzern erhofft noch bis Ende April eine bedingte EU-weite Marktzulassung zu erteilen, sondern zu dieser Entscheidungsfindung nun nicht nur eine nochmals konkretere Begründung allein schon ihrer bedingten Zulassungsantragsstellung, sondern zudem noch ergänzende weitere Dateneinreichungen an die EMA erforderlich seien.
 Auch wenn diese weitere Datenanforderung durch die EMA wenigstens dahingehend noch halbwegs positiv zu werten ist, dass hiermit zumindest bislang noch keine endgültige und für den Konzern wie auch dessen Aktie andernfalls zweifellos völlig desaströse EU-Zulassungsablehnung von VLA2001 erfolgt ist, so stößt doch diese neuerliche Dateneinreichungsauflage der EMA in weiten Teilen auf unser und offenbar auch im Vorstand von Valneva bzw. ihrem Vorsitzenden Thomas Lingelbach ähnlich ausgeprägtes Unverständnis.
Auch wenn diese weitere Datenanforderung durch die EMA wenigstens dahingehend noch halbwegs positiv zu werten ist, dass hiermit zumindest bislang noch keine endgültige und für den Konzern wie auch dessen Aktie andernfalls zweifellos völlig desaströse EU-Zulassungsablehnung von VLA2001 erfolgt ist, so stößt doch diese neuerliche Dateneinreichungsauflage der EMA in weiten Teilen auf unser und offenbar auch im Vorstand von Valneva bzw. ihrem Vorsitzenden Thomas Lingelbach ähnlich ausgeprägtes Unverständnis.
EMA-Maßstäbe neuer Dateneinreichungsauflagen nur schwer nachvollziehbar
Denn zunächst einmal ist klarzustellen, dass eine BEDINGTE Zulassungsbeantragung und auch fallweise anschließende positive Bescheidung eines solchen Antrags in rechtlich exakt dem gleichen Rahmen, wie am 14.04.2022 auch die rechtlich völlig adäquate bedingte Zulassung der britischen Gesundheitsaufsichtsbehörde MHRA erfolgt war (siehe hierzu auch unsere letzte Analyse) üblicherweise ausschließlich auf der anerkannten Prämisse beruht, dass selbst bisher eingereichte „lückenhafte Daten“ eine „hinreichende Gewähr“ dafür bieten müssen, dass eine besonders zeitkritische bedingte Zulassung (= im Sprachgebrauch der US-amerikanischen FDA auch als Notfallzulassung / EUA bezeichnet) vom medizinischen Versorgungsstandpunkt her in diesem Fall dennoch einen zweifelsfreien Vorteil gegenüber einer umfangreicheren Datenauswertung mit dem Nachteil einer zeitlich erst späteren Vollzulassung liefert.
Und nach exakt dieser Prämisse und ihrer abschließenden positiven Beurteilung durch die EMA haben selbst bislang auch alle weiteren in Deutschland zugelassenen Corona-Vakzine, nämlich von BIONTECH (US09075V1026) / PFIZER (US7170811035), MODERNA (US60770K1079), JOHNSON & JOHNSON (US4781601046), ASTRAZENECA (GB0009895292) und selbst auch Valneva’s direktester Totimpfstoff-Konkurrent NOVAVAX (US6700024010) bis heute ja ebenfalls lediglich den Status einer bedingten (Notfall-), aber keinesfalls einer auf entsprechend umfangreicheren Studienreihen basierten Vollzulassung erhalten!
Weshalb aber ausgerechnet Valneva nach der EMA-Anforderung bereits ihre bedingte Zulassungs-ANTRAGSSTELLUNG nun auch sogar noch einmal überhaupt argumentativ belegen soll, nachdem die britische MHRA in ihrer bedingten Zulassungsgenehmigung vom 14.04. ihrerseits VLA2001 explizit eine einwandfreie „Erfüllung aller erforderlichen Sicherheits-, Qualitäts- und Wirksamkeitsstandards bescheinigt hatte“ und dies im Übrigen auch voll mit den Ergebnissen der Basis-Vergleichsstudien-Einreichung gegen den Vektorimpfstoff von AstraZeneca / AZD1222 bereits im Oktober 2021 korrespondiert hatte (u.a. 95%ige Infektionsverhinderung ab 2 Wochen nach Erhalt der Zweitimpfung; 39% höhere Antikörpertiter-Bildung von VLA2001 als bei AZD1222; in nur 73,2 % der Fälle übliche systemische Haut- und Muskelreaktionen, verglichen mit 73,2 % bei ATD1222; zudem vor allem gegenüber bisherigen mRNA-Vakzinen weit problemlosere und längere Lagerbarkeit bereits bei Kühlschranktemperaturen von bis zu 6 Grad wie auch generell sehr umfangreiche Therapievergleichsbasis klassischer Totimpfstoff-Verfahren wie z.B. gegen Polio, Grippe und Hepatitis A; siehe hierzu auch diese damalige Analyse von uns) erschließt sich für uns gegenwärtig in keiner Weise.
Lediglich die damalige nachgereichte Studie von Valneva von Mitte Januar 2022 zur vermeintlichen Omikron-Neutralisierung von VLA2001 erschien uns in der Tat seinerzeit noch als äußerst limitiert (siehe hier). Jedoch kann und darf dies unseres Erachtens angesichts der bisher völlig fehlenden Zulassung jeglichen speziellen Omikron-Vakzins bzw. genauso wenig existenter weitaus umfangreicherer Omikron-Studienbelege anderer Vakzinhersteller natürlich ebenso wenig ein hypothetischer Grund sein, VLA2001 nun künftig deshalb ggfs. die Zulassung zu verweigern, wie auch generell VLA2001 künftig natürlich von der EMA ebenso völlig objektiv und ISOLIERT zu bewerten und einzustufen ist, wie dies ja offensichtlich seinerzeit auch bei den Vakzinen von BioNTech/Pfizer, Moderna, Johnson & Johnson, AstraZeneca und Novavax wie aber auch generell durch die MRHA praktiziert wurde, OHNE dabei aber scheinbar auch all diese Impfstoffe noch einmal einem etwaigen RELATIVEN Qualitäts-Quervergleich zueinander zu unterziehen.
In dieser Hinsicht hoffen wir also grundsätzlich sehr, dass auch im Falle von VLA2001 die EMA künftig exakt denselben Objektivitätsmaßstab für ihre Zulassungsentscheidung (wie ihn auch die MHRA bewiesen hat) anlegen und nicht etwa nun deshalb künftig mit „zweierlei Maß“ relativ zu allen anderen Vakzinproduzenten messen wird, nur weil jetzt etwa z.B. die Corona-Pandemie schon weiter fortgeschritten ist oder auch die Impfnachfrage nach dem Vakzin von Novavax aktuell EU-weit offenbar äußerst bescheiden ausfällt.
Nach ergänzender Verlautbarung einer Unternehmenssprecherin von Valneva beziehen sich die gestellten Datenanforderungen seitens der EMA im Übrigen neben einigen untergeordneten Subanalysen nun konkret vor allem auf weiter offene Fragen zur Antikörperbildung wie auch der sog. „Bindung“ von VLA2001, die ja wie bei allen Totimpfstoff-Verfahren üblich, zu ihrer Wirkungsverstärkung in der finalen Herstellung grundsätzlich mit sog. Adjuvans-Substanzen kombiniert werden. Auch letzte prozesstechnische Freigabeerfordernisse auf den Ebenen der Vakzin-Rezeptur, der effektiven Produktion und begleitenden Herstellungskontrolle fehlen der EMA derzeit angeblich ebenfalls noch.
Laut CEO Lingelbach ist Valneva zuversichtlich, nach der in den nächsten Tagen durch den Konzern erfolgenden Beantwortung aller noch offenen Fragen nun bis zum Ende des 2. Quartals die EMA-Zulassung für VLA2001 zu erwirken.
 Auch wenn dieser Zeitplan angesichts der erst Mitte Juni stattfindenden nächsten ordentlichen CHMP-Sitzung nun sehr knapp bemessen ist, sehen wir die Chancen für eine letztlich erfolgende EU-Zulassung auch weiterhin als vollauf gegeben an, da nach allen Studienvorergebnissen, den zurückliegenden und kommenden Dateneinreichungen von Valneva wie aber auch der jüngsten MHRA-Zulassung und deren Begründung die EMA unseres Erachtens im Umkehrschluss wohl sehr entscheidende und triftige Gründe wird vorbringen müssen (die wir derzeit jedoch kaum ausmachen können), um einer VLA2001-Zulassung künftig tatsächlich mit jeglicher Berechtigung rundweg eine Absage zu erteilen.
Auch wenn dieser Zeitplan angesichts der erst Mitte Juni stattfindenden nächsten ordentlichen CHMP-Sitzung nun sehr knapp bemessen ist, sehen wir die Chancen für eine letztlich erfolgende EU-Zulassung auch weiterhin als vollauf gegeben an, da nach allen Studienvorergebnissen, den zurückliegenden und kommenden Dateneinreichungen von Valneva wie aber auch der jüngsten MHRA-Zulassung und deren Begründung die EMA unseres Erachtens im Umkehrschluss wohl sehr entscheidende und triftige Gründe wird vorbringen müssen (die wir derzeit jedoch kaum ausmachen können), um einer VLA2001-Zulassung künftig tatsächlich mit jeglicher Berechtigung rundweg eine Absage zu erteilen.
Unser bisheriges Votum SPEKULATIV HALTEN behalten wir daher weiterhin unverändert bei, worin wir uns zudem auch charttechnisch durch die weiterhin vollkommen intakte Bewahrung sowohl des im März 2020 etablierten steilen wie auch des seit Februar 2021 nur noch sehr flachen Aufwärtstrends ebenfalls selbst nach dem heutigen Aktieneinbruch bestätigt sehen.
Chart: VALNEVA
Valneva auf TradingView
26.04.2022 - Matthias Reiner
Auf Twitter teilen Auf Facebook teilen
Informiert bleiben - Wenn Sie bei weiteren Nachrichten und Analysen zu einem in diesem Artikel genannten Wert oder Unternehmen informiert werden möchten, können Sie unsere kostenfreie Aktien-Watchlist nutzen.
Folgende Artikel könnten Sie auch interessieren
Ihre Bewertung, Kommentar oder Frage an den Redakteur
Haftungsausschluss - Die EMH News AG übernimmt keine Haftung für die Richtigkeit der Empfehlungen sowie für Produktbeschreibungen, Preisangaben, Druckfehler und technische Änderungen. (Ausführlicher Disclaimer)






 26.08.2025
26.08.2025
 14.09.2024
14.09.2024
 14.11.2023
14.11.2023
 14.11.2023
14.11.2023