Valneva: Weiter SPEKULATIV HALTEN – Jetzt fehlt nur noch die EMA-Zulassung von VLA2001
Ausgang der kommenden EMA-Entscheidung nun hoch brisant

Völlig überraschend vermeldete die französische VALNEVA, der weltweit erste Hersteller eines sog. Ganzkörper-Totimpfstoffs gegen das Corona-Virus auf Basis auf chemisch deaktivierter Spike- (S-) , Matrix- (M-) und Nucleo- (N-)Proteine des tierischen SarsCov2-Basisvirus, heute Morgen die erfolgte Zulassung des entsprechenden Vakzins VLA2001 durch die britische Gesundheitsaufsichtsbehörde MHRA. Denn nachdem die britische Regierung noch im September 2021 ihre ursprüngliche Liefervereinbarung über 100 Mio. Impfdosen von VLA2001 wegen angeblicher Vertragsverletzungen von Valneva ersatzlos storniert hatte, hatten sicher nur die Wenigsten im Umfeld der fortgeschrittenen Corona-Pandemie und zuvor bereits 5 weiterer zugelassener Covid19-Vakzine in Großbritannien nun noch eine weitere Genehmigung ausgerechnet von VLA2001 erwartet.
Folgerichtig verzeichnet die Aktie von VALNEVA (FR0004056851) nach ihrer Aussetzung bis um 14 MEZ im aktuellen Tradegate-Handel nun einen Kurssprung um fast + 11 % auf derzeit 16,85 EUR, womit wir uns in der zuletzt am 28.03. in Erwartung einer künftigen Zulassung durch die europäische EMA (aber kaum durch die MHRA !) abgegebenen Empfehlung (siehe hier), die Aktie SPEKULATIV zu HALTEN, nun umso mehr bestätigt sehen.
 Wie wir in dieser letzten Analyse klar betont hatten, rechneten wir nun kaum mehr mit einer Zulassung von VLA2001 ausgerechnet in Großbritannien, da deren Gesundheitsministerium Mitte September 2021 unter dem von Valneva auch bis heute vehement bestrittenen Vorwurf, sie habe seinerzeit gegen essenzielle vereinbarte Vertragsbedingungen verstoßen, dieses zuvor sogar noch von 60 auf 100 Mio. Lieferdosen ausgeweitete Abkommen vollständig aufkündigte.
Wie wir in dieser letzten Analyse klar betont hatten, rechneten wir nun kaum mehr mit einer Zulassung von VLA2001 ausgerechnet in Großbritannien, da deren Gesundheitsministerium Mitte September 2021 unter dem von Valneva auch bis heute vehement bestrittenen Vorwurf, sie habe seinerzeit gegen essenzielle vereinbarte Vertragsbedingungen verstoßen, dieses zuvor sogar noch von 60 auf 100 Mio. Lieferdosen ausgeweitete Abkommen vollständig aufkündigte.
Dagegen stellt die MHRA mit ihrer jetzigen Zulassungsentscheidung ihre schon jederzeit herausgestellte und auch in ihrem heutigen Statement nochmals betonte, völlige und allein wissenschaftlich geprägte Unabhängigkeit von jeglichen externen (auch politischen) Einflussnahmen eindrucksvoll unter Beweis, was natürlich aus unserer Sicht grundsätzlich hoch anzuerkennen ist.
Lieferabkommen mit britischer Regierung steht selbst nach MHRA-Zulassung weiter in den Sternen
In diesem Zuge stellt sich allerdings wiederum andererseits nun die völlig offene Frage, ob und inwiefern diese jetzige offizielle Zulassung der MHRA der britischen Regierung strategisch wie taktisch denn überhaupt nun ins „politische Kalkül“ passt, da diese nach ihrer eigenen vorherigen Vertragskündigung, den zuvor in Großbritannien bereits 5 zugelassenen Corona-Impfstoffen, dem sicher weiter abklingend voranschreitenden Verlauf der Pandemie und aber auch der vehementen politischen Zurückweisung jeglicher erneuter Corona-Abwehrregelverschärfungen (trotz bislang weiter hoher Tagesneuinfektionen in Großbritannien) dem VLA2001-Impfstoff nach unserer Einschätzung doch unverändert reserviert, wenn nicht gar ablehnend gegenüberstehen dürfte.
Die Aussicht, ob selbst nach der heutigen MHRA-Zulassung von VLA2001 Valneva künftig der Abschluss eines erneuten Lieferabkommens mit der britischen Regierung gelingen wird, halten wir daher weiterhin für völlig ungeklärt, wenn nicht gar fraglich, so dass es neben der bereits im März erfolgten Zulassung durch die Gesundheitsbehörde von Bahrain sowie der darauf seit Anfang April gestarteten Auslieferung der zugesicherten Menge von 1 Mio. Impfdosen nun zunächst weiter erst einmal nur bei den derzeit außerdem laufenden Verhandlungen mit der schottischen Regierung zur Auslieferung von max. 25.000 Impfdosen an deren nationales Gesundheitsamt bleiben dürfte.
VLA2001-Zulassung durch die EMA trotz heutiger MHRA-Entscheidung weiter ungewiss
Auf der anderen Seite, was perspektivisch fraglos weitaus relevanter ist, stufen wir es objektiv aber gleichfalls als völlig intransparent und ungewiss ein, ob denn die heutige MHRA-Zulassung von VLA2001 ebenso auch die weiterhin ausstehende Zulassungsentscheidung der europäischen Arzneimittelzulassungsbehörde EMA bzw. ihres hierzu empfehlungsgebenden maßgeblichen Wissenschaftsbeirats CHMP künftig in irgendeiner Form begünstigen wird, nachdem ja der CHMP-Leiter des Bereichs für „Biologische Gesundheitsrisiken und Impfstrategien“, Dr. Marco Cavaleri, trotz jüngster weiterer Studiendateneinreichungen von Valneva stets die völlige Offenheit einer „etwaigen Zulassungsentscheidung kaum vor Ostern“ betont hatte und sich in der Tat die CHMP zu ihrer nächsten turnusmäßigen Sitzung nun erst vom 19. – 22.04. zusammenfinden wird (mit der auch völlig weiter bestehenden Unklarheit, ob selbst zu diesem Termin denn eine Zulassungsentscheidung von VLA2001 überhaupt auf der Agenda stehen wird).
Dennoch, zumindest so viel kann unseres Erachtens mit Fug und Recht gesagt werden, dürfte die heutige VLA2001-Zulassungsentscheidung der MHRA für 18-50jährige Impfstoffempfänger, die in ihrem entsprechend positiven Statement explizit sowohl die schlüssigen Studiendaten für die hohe Effizienz von 2 Impfungen im Abstand von mindestens 4 Wochen, die generell gebräuchliche Verwendung des von Valneva angewandten Totimpfstoff-Verfahrens auch für andere praxiserprobte klassische Impfstoffgebiete wie Grippe und Polio, die berechtigte Aussicht der Wirksamkeit des Ganzkörper-Umfangs von VLA2001 auch gegen viele weitere Corona-Varianten sowie schließlich die im Vergleich zu mRNA-Aktivimpfstoffen zudem weitaus längere und temperaturbeständigere Lagerbarkeit von VLA2001 herausgestellt hat, der Aussicht auf eine künftig ebenfalls möglicherweise positiv ausfallenden Zulassungsentscheidung der EMA kaum abträglich sein, so dass der auf den ersten Blick sicher sehr deutlich ausgefallene Kurssprung der Valneva-Aktie sicher auch zum wesentlichen Teil mit zu Recht gestiegenen Anlegerhoffnungen auf ein künftig ebenso positiv ausfallendes Zulassungsurteil der EMA begründet werden kann.
Positive EMA-Entscheidung mit weiterem starken Aktienkurs-Potenzial verbunden
Sollte es künftig zu einer entsprechenden Einsatzgenehmigung von VLA2001 durch die EMA kommen, würde es zwar auch im Falle der von der EU-Kommission bis 2023 zugesagten Option zur Abnahme von maximal 60 Mio. Impfdosen (davon Festvereinbarung für 24,3 Mio. Impfdosen in 2022) genauso offen bleiben, in welchem Maße die EU von ihrer Bezugsoption über die verbleibenden 35,7 Mio. Dosen denn in 2023 tatsächlich Gebrauch machen wird, da sich auch in der EU dem Vernehmen nach seit der ab Anfang März erfolgten Erstauslieferung des zugelassenen (Teilkörper-)Totimpfstoff-Vakzins des Konkurrenten NOVAVAX (US6700024010) die Impfbereitschaft in deren Vakzin NUVAXOVID bislang als äußerst bescheiden erwiesen hat (so z.B. in Deutschland bis zur dritten März-Woche gerade nur einmal rd. 2,9 % des Erstauslieferungs-Kontingents von 1,4 Mio. Impfdosen).
Nichtsdestotrotz dürfte im Falle einer nun auch folgenden künftigen EMA-Zulassung von VLA2001 die Valneva-Aktie daraufhin natürlich einen nochmals umso gewaltigeren Kurssprung hinlegen, weshalb wir in dieser weiterhin gerechtfertigten Erwartung unser bisheriges Votum SPEKULATIV HALTEN nun erneut nachdrücklich bekräftigen.
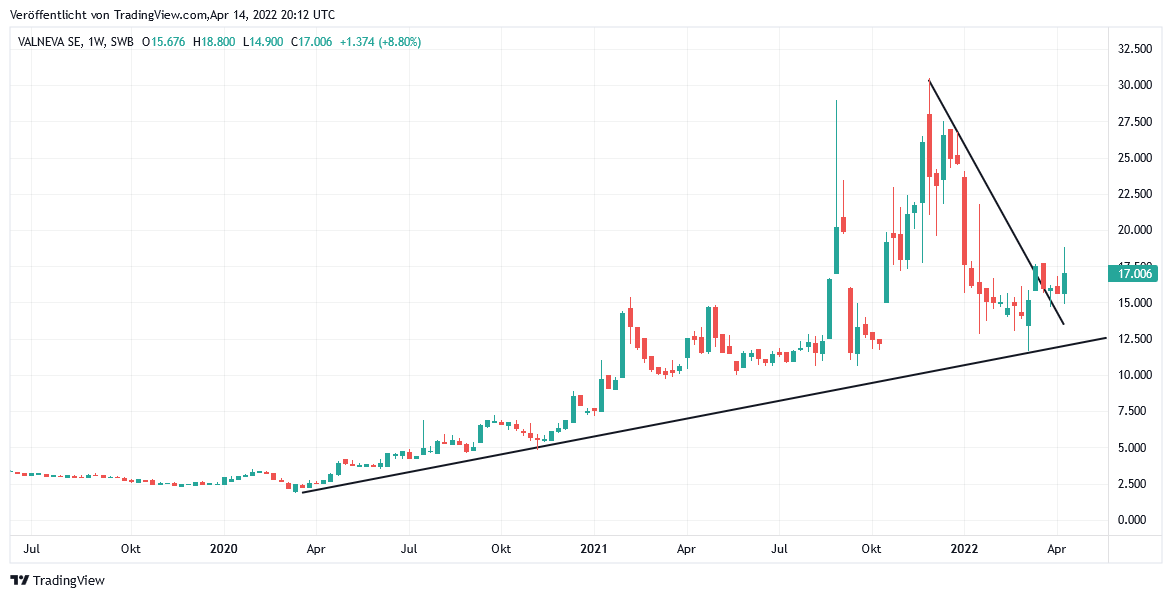
 Allein auf einen prozyklisch zu stark ausfallenden Aktienkursanstieg im Falle einer künftigen positiven EMA-Zulassungsentscheidung, d.h. bis in die Nähe des Rekordhochs von ca. 30 EUR, sollten unseres Erachtens Anleger vor dem Hintergrund der ab 2023 unklaren effektiven Auslieferungsmenge von VLA2001 an die EU künftig zumindest vorübergehend mit Gewinnmitnahmen reagieren, was aber erst Recht auch für einen grundsätzlichen Verkauf der Aktie gilt, sollte die EMA einer Zulassungsgenehmigung von VLA2001 künftig endgültig eine Absage erteilen und die Aktie in diesem Fall ihre aktuelle Trendunterstützung bei ca. 12 EUR sicher schlagartig verletzen.
Allein auf einen prozyklisch zu stark ausfallenden Aktienkursanstieg im Falle einer künftigen positiven EMA-Zulassungsentscheidung, d.h. bis in die Nähe des Rekordhochs von ca. 30 EUR, sollten unseres Erachtens Anleger vor dem Hintergrund der ab 2023 unklaren effektiven Auslieferungsmenge von VLA2001 an die EU künftig zumindest vorübergehend mit Gewinnmitnahmen reagieren, was aber erst Recht auch für einen grundsätzlichen Verkauf der Aktie gilt, sollte die EMA einer Zulassungsgenehmigung von VLA2001 künftig endgültig eine Absage erteilen und die Aktie in diesem Fall ihre aktuelle Trendunterstützung bei ca. 12 EUR sicher schlagartig verletzen.
Chart: VALNEVA
Valneva auf TradingView
14.04.2022 - Matthias Reiner
Auf Twitter teilen Auf Facebook teilen
Informiert bleiben - Wenn Sie bei weiteren Nachrichten und Analysen zu einem in diesem Artikel genannten Wert oder Unternehmen informiert werden möchten, können Sie unsere kostenfreie Aktien-Watchlist nutzen.
Folgende Artikel könnten Sie auch interessieren
Ihre Bewertung, Kommentar oder Frage an den Redakteur
Haftungsausschluss - Die EMH News AG übernimmt keine Haftung für die Richtigkeit der Empfehlungen sowie für Produktbeschreibungen, Preisangaben, Druckfehler und technische Änderungen. (Ausführlicher Disclaimer)






 26.08.2025
26.08.2025
 14.09.2024
14.09.2024
 14.11.2023
14.11.2023
 14.11.2023
14.11.2023