Valneva: Mit breitem Impfstoff-Portfolio trotz ungeklärter VLA2001-EU-Zulassung vorerst attraktiver als BioNTech + Moderna
EU-Zulassung von VLA2001 allein ausschlaggebend für weitere Aufwärtstrend-Behauptung
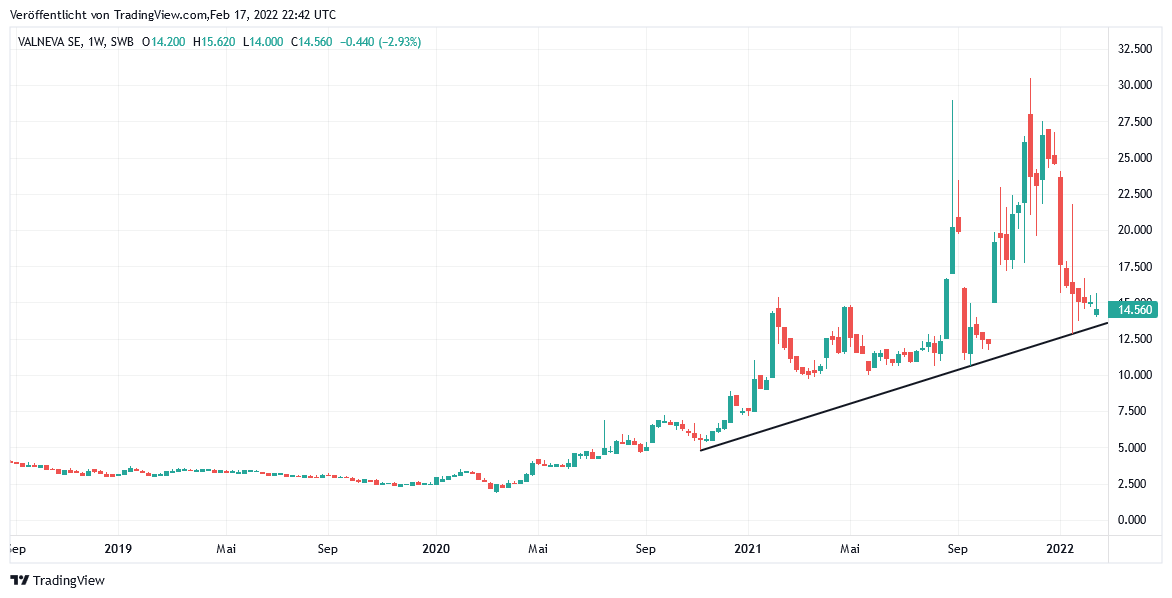
Auch heute schwächt sich die Aktie des französischen Entwicklers eines weiteren designierten Tot-, d.h. aus deaktivierten Virenproteinen bestehenden Impfstoffs gegen das Corona-Virus, VALNEVA, im Tagesverlauf derzeit erneut um rd. - 4 % auf rd. 14,77 EUR (Tradegate) ab, was wir vor allem dem heute wieder einmal schwachen Technologie- und Impfstoffaktien-Umfeld (z.B. auch BioNTech -3 %, Moderna - 1,5 %) wie auch der weiteren Hängepartie in der anvisierten EU-Zulassung ihres Corona-Impfstoffkandidaten VLA2001 zuschreiben. Dennoch kann der derzeit relevanteste, im Dezember 2020 initiierte Sekundär-Aufwärtstrend damit vorerst auch weiterhin erfolgreich behauptet werden.
Die gegenüber ihren Covid19-Impfstoff-Hauptkonkurrenten BIONTECH (US09075V1026) und MODERNA (US60770K1079), deren Aktien angesichts ihrer einzig profitablen Monoprodukt-Konzentration auf die Corona-Impfstoffe COMIRNATY bzw. SPIKEVAX sowie einem symptomatisch künftig unzweifelhaft immer entspannteren Corona-Umfeld bereits seit spätestens Oktober 2021 völlig zu Recht in einen bisher völlig ungebrochenen Korrekturtrend übergegangen sind, weiterhin wesentlich günstigere Chartkonstellation von VALNEVA (FR0004056851) ist dabei auch nur allzu begründet und wurde seit 2 Wochen auch durch zwei unseres Erachtens sehr positiv zu wertende Nachrichten nur nochmals bestätigt.
Solide Umsatzentwicklung in 2021
Zum einen publizierte Valneva am 03.02. vorab zu ihrer kompletten Jahresergebnisveröffentlichung 2021 am 24.03. Umsatzzahlen, nach denen sich die Erlöse aus bestehenden Impfstoffprodukten und -Entwicklungskooperationen gegenüber dem Vorjahr zwar um – 14 % auf knapp 95 Mio. EUR ermäßigten, jedoch lag diese Umsatzvereinnahmung damit am oberen Rand der zuvor vom Konzern mit 85 – 100 Mio. EUR angepeilten Spanne.
 Inklusive eines weiteren gewaltigen Einnahmenzuflusses von rd. 253 Mio. EUR an fest zustehenden Zahlungen aus dem am 13.09.2021 von der britischen Regierung aufgekündigten abgeschlossenen Covid19-Impfstoff-Lieferabkommen (Anlass waren seinerzeit angebliche Vertragsverletzungen durch Valneva, die der Konzern jedoch bis heute vehement bestreitet und ihn auch nicht an der weiter fortgeführten Zulassungsbeantragung bei der britischen Gesundheitsbehörde MRHA hindert) hat sich der Konzernumsatz in 2021 jedoch mit 348 Mio. EUR sogar mehr als verdreifacht.
Inklusive eines weiteren gewaltigen Einnahmenzuflusses von rd. 253 Mio. EUR an fest zustehenden Zahlungen aus dem am 13.09.2021 von der britischen Regierung aufgekündigten abgeschlossenen Covid19-Impfstoff-Lieferabkommen (Anlass waren seinerzeit angebliche Vertragsverletzungen durch Valneva, die der Konzern jedoch bis heute vehement bestreitet und ihn auch nicht an der weiter fortgeführten Zulassungsbeantragung bei der britischen Gesundheitsbehörde MRHA hindert) hat sich der Konzernumsatz in 2021 jedoch mit 348 Mio. EUR sogar mehr als verdreifacht.
Zwar war die eigentliche Minderung ihres bereits bestehenden Produktumsatzes um – 14 % in 2021 nicht als besonders erfreulich einzustufen, jedoch war der hierfür wesentliche Hintergrund von Umsatzrückgängen ihrer bereits markteingeführten Impfstoffe Ixiaro (gegen japanische Enziphalitis) sowie Dukoral (gegen Cholera) wenigstens ein erneuter Beleg, dass Valneva in ihrem Impfstoffspektrum bereits jetzt schon deutlich breiter aufgestellt ist, als ihre schärfsten Corona-Vakzinkonkurrenten BioNTech und Moderna, und hieraus auch weiterhin mit hoch relevanten Zusatz-Umsatzbeiträgen über die künftig anvisierte Zulassung von VLA2001 in der EU, Bahrain und Großbritannien hinaus zu rechnen ist.
Zudem explodierte auch wenigstens im Teilsegment des Impfstoffabsatzes für Dritte – ein weiteres Diversifikations-Standbein, das BioNTech und Moderna nicht besitzen – der Umsatz um 271 % auf über 15 Mio. EUR, dem eine entsprechende Vertriebsvereinbarung mit Bavarian Nordic, dem Entwickler der Impfstoffe Rabipur/RabaVert (gegen Tollwut) und Encepur (gegen Zeckenenzephalitis) zugrunde lag.
2022er Umsatzperspektiven allein von künftigen VLA2001-Zulassungen abhängig
Die Realisierung des Ziels von Valneva, in 2022 allein aus dem laufenden Geschäft nun sogar einen Umsatz von 430 – 590 Mio. EUR erzielen zu wollen ist, ist jedoch momentan natürlich auch weiterhin völlig offen, da der Konzern in diese Projektion die für das 1. Quartal anvisierte erfolgreiche Zulassung ihres Covid-Vakzinkandidaten VLA2001 vor allem sowohl in der EU wie auch in Bahrain bereits voll mit inkludiert hat.
So entfallen auf obige Konzernumsatz-Zielspanne für 2022 nun nicht weniger als 350 – 500 Mio. EUR allein auf die künftig erhofften behördlichen VLA2001-Zulassungen, denen im Falle entsprechend positiver Zulassungsbescheide die bereits vorab mit der EU getroffene Festvereinbarung zur Lieferung von 24,3 Mio. Impfdosen (bis Ende 2023 sogar optional aufstockungsfähig bis auf max. 60 Mio. Impfdosen), die Festvereinbarung mit Bahrain zur Auslieferung von 1 Mio. Impfdosen wie auch von Valneva nach positiven Zulassungsbescheiden unterstellte weitere Orders von ca. 2 – 3 Mio. Impfdosen aus weiteren Ländern, in denen Valneva derzeit ebenfalls an Covid 19-Impfstoffausschreibungen teilnimmt, zugrunde liegen.
Wie wir bereits in diesen beiden zurückliegenden Artikeln hier und hier deutlich betont haben und an dieser Stelle nochmals wiederholen, ließ jedoch der Leiter der Abteilung für biomedizinische Infektionskrankheiten und entsprechende Impfstoffstrategien bei der EU-Zulassungsbehörde EMA, Dr. Marco Cavaleri, am 18.01. unmissverständlich verlauten, dass die EMA noch zusätzliche Daten für die Zulassungsentscheidung von VLA 2001 benötigen würde und dass diese Überprüfung daher noch (weiter wörtlich) „über die kommenden Monate hinweg weiter fortgesetzt würde und möglicherweise zu einer Zulassungsgenehmigung in nicht allzu ferner Zeit“ führen würde.
Diese ernüchternde Aussage präzisierte Cavaleri in einer letzten Pressekonferenz vom 03.02. noch weiter dahingehend, dass selbst auch nach den mittlerweile erfolgten weiteren Ergebniseinreichungen von Valneva zu zurückliegenden VLA2001-Tests an Erwachsenen ALLER Altersgruppen (hierin sah die EMA zuvor offenbar noch die größte Lückenhaftigkeit) derzeit auch weiterhin nicht mit Bestimmtheit gesagt werden könne, ob eine Zulassungsentscheidung der EMA für VLA2001 „bis Ostern möglich sei“.
Gerade auch nach dieser weiter konkretisierenden Aussage von Cavaleri sehen wir den Zeitplan von Valneva, noch im 1. Quartal eine EU-Zulassung von VLA2001 zu erwirken, daher mittlerweile als hochgradig gefährdet, wenn nicht gar als unwahrscheinlich an, so dass natürlich angesichts der vollen Einbeziehung dieses Zulassungserfolgs in ihre Umsatzprojektionen gerade auch der immer noch denkbare Worst-Case einer künftig kompletten Zulassungsverweigerung durch die EMA in diesem Fall unweigerlich einen radikalen Rückschlag in allen entsprechenden Konzernplänen darstellen und am Tage einer solchen Meldung auch die Valneva-Aktie ohne Frage prozentual deutlich zweistellig einbrechen würde.
Fortschritte in Borreliose-Vakzin (mit Pfizer) Beleg für den Diversifikations-Vorsprung von Valneva
Über diese an sich sehr positive Umsatzentwicklung und -ankündigung von Valneva hinaus, die für 2022 jedoch auch weiterhin unter dem alles entscheidenden Vorbehalt der künftig erfolgreichen EU-Zulassung von VLA2001 steht, erfreute Valneva die Analysten wie Anleger am 06.02. mit der weiteren, aus unserer Sicht perspektivisch hoch zu würdigenden Meldung, dass man nach sehr erfolgreichen Phase 2-Testungen des zusammen mit ihrem Partner PFIZER (US7170811035) weiteren entwickelten Impfstoffs VLA15 gegen die durch Zeckenbisse ausgelöste Lyme-Borreliose an Erwachsenen im Alter von über 18 Jahren sehr zuversichtlich sei, dass auch die laufende Phase 2-Studie an 5- bis 17-jährigen Kindern und Jugendlichen bis zum voraussichtlichen Abschluss im 2. Quartal 2022 ähnlich positive Ergebnisse erbringe, und man daraufhin ab dem 3. Quartal vermutlich die abschließende 3. klinische Studienreihe mit Probanden aller Altersgruppen und bei Verabreichung einer nochmals wirksameren Dreifach-Impfung starten könnte.
In diesem Fall, so Valneva weiter, sei mit ersten Ergebnissen aus dieser umfassenden 3. klinischen Studie wohl gegen Jahresende 2022 zu rechnen, was im Falle positiver Testresultate dann eine internationale Zulassungsbeantragung innerhalb des 1. Halbjahres 2023 möglich machen könnte.
 Auch mit dieser derzeit offenbar sehr erfolgreichen Fortentwicklung ihres Borreliose-Vakzinkandidaten VLA15, der bei finalem Zulassungserfolg auch der bisher weltweit einzige gegen diesen Typ der Vireninfektion wäre, unterstreicht Valneva somit einmal mehr ihre gegenüber BioNTech und Moderna unvergleichlich starke Fortschrittlichkeit in der Entwicklung gleich eines gesamten und in o.g. 2 Fällen gegen japanische Enziphalitis sowie Cholera sogar auch bereits marktlancierten Impfstoffspektrums, was nach den Planungen von Valneva außerdem bis zum Jahresende 2022 oder spätestens Anfang 2023 durch die nächste Zulassung ihres weiteren Impfstoffs VLA1553 gegen das in Afrika und Südostasien verbreitete Chikungunya-Stechmücken-Virus abgerundet werden soll.
Auch mit dieser derzeit offenbar sehr erfolgreichen Fortentwicklung ihres Borreliose-Vakzinkandidaten VLA15, der bei finalem Zulassungserfolg auch der bisher weltweit einzige gegen diesen Typ der Vireninfektion wäre, unterstreicht Valneva somit einmal mehr ihre gegenüber BioNTech und Moderna unvergleichlich starke Fortschrittlichkeit in der Entwicklung gleich eines gesamten und in o.g. 2 Fällen gegen japanische Enziphalitis sowie Cholera sogar auch bereits marktlancierten Impfstoffspektrums, was nach den Planungen von Valneva außerdem bis zum Jahresende 2022 oder spätestens Anfang 2023 durch die nächste Zulassung ihres weiteren Impfstoffs VLA1553 gegen das in Afrika und Südostasien verbreitete Chikungunya-Stechmücken-Virus abgerundet werden soll.
In dieser weitaus breiter diversifizierten und dazu auch noch fortgeschritteneren Impfstoff-Positionierung von Valneva geben wir deren Aktie daher auch weiterhin einen klaren Anlagevorzug gegenüber ihren bislang einzig in der Corona-Impfstoffforschung profitablen und damit perspektivisch stark ertragsgefährdeten Konkurrenten BioNTech und Moderna.
Dennoch stufen wir aber auch die Valneva-Aktie momentan völlig unverändert zu unserer letzten Analyse vom 27.01. weiterhin lediglich als SPEKULATIV HALTENSWERT ein, da eine künftig auf unabsehbare Zeit weiter hinausgeschobene oder im schlechtesten Fall gar endgültig verweigerte EMA-Zulassung ihres Corona-Vakzinkandidaten VLA2001 ohne jede Frage einen gewaltigen Aktiencrash zur Folge hätte.
Chart: VALNEVA
Valneva auf TradingView
18.02.2022 - Matthias Reiner
Auf Twitter teilen Auf Facebook teilen
Informiert bleiben - Wenn Sie bei weiteren Nachrichten und Analysen zu einem in diesem Artikel genannten Wert oder Unternehmen informiert werden möchten, können Sie unsere kostenfreie Aktien-Watchlist nutzen.
Folgende Artikel könnten Sie auch interessieren
Ihre Bewertung, Kommentar oder Frage an den Redakteur
Haftungsausschluss - Die EMH News AG übernimmt keine Haftung für die Richtigkeit der Empfehlungen sowie für Produktbeschreibungen, Preisangaben, Druckfehler und technische Änderungen. (Ausführlicher Disclaimer)






 26.08.2025
26.08.2025
 14.09.2024
14.09.2024
 14.11.2023
14.11.2023
 14.11.2023
14.11.2023