BioNTech: SPEKULATIV HALTEN – Impulse durch Omikron-BA.2-Typ und Zweit-Boosterung für über 65-Jährige
Wie lange hält der Stabilisierungstrend?
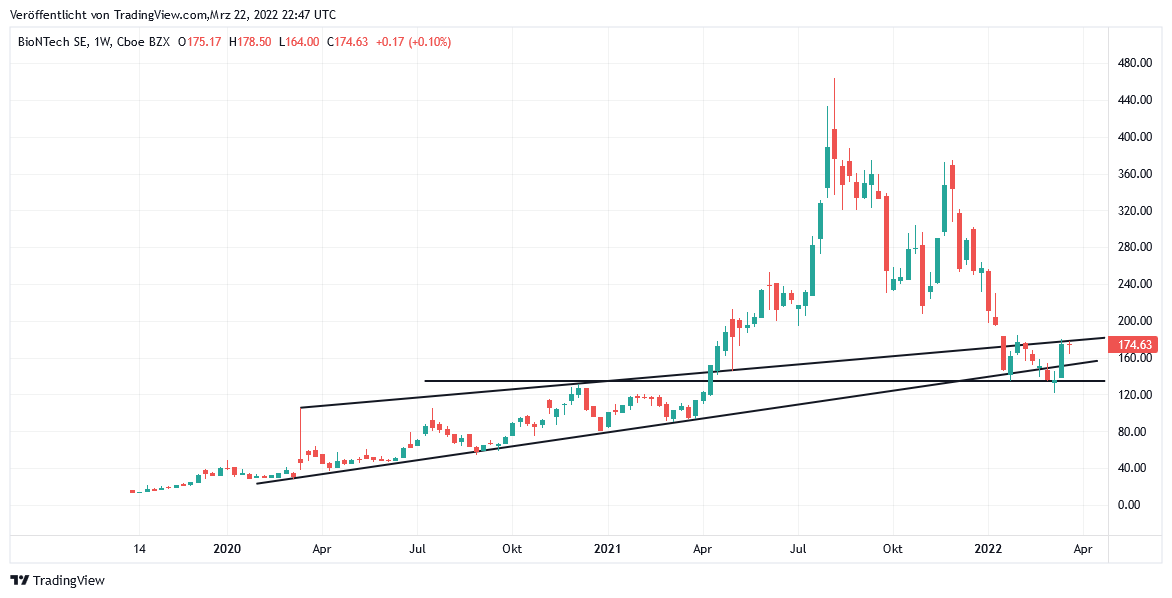
Seit dem 14.03. verzeichnete die Aktie der Mainzer BIONTECH einen erneut elementar wichtigen Ausbruch über die derzeit entscheidende Unterstützungsmarke von 145 USD. Die Aktie schwenkte damit, nach noch kräftiger Unterschreitung bis auf ein Tief von 121 USD in der Vorwoche (gleichbedeutend mit einem Crash um – 74 % gegenüber dem Rekordhoch vom August 2021) nun wenigstens wieder in ihren Mitte März 2020 etablierten, grundlegenden Primäraufwärtstrend zurück.
Der seit 14.03. wieder deutlich freundlicheren Aktienentwicklung von BIONTECH (US09075V1026) lagen dabei bis heute (aktueller Kurs 175 USD) im Wesentlichen 3 begünstigende Faktoren zugrunde:
1) Das seit 01.03. bislang nur wenig gebremste neue Hochschießen täglicher Corona-Neuinfektionsfälle in China von rd. 200 bis zuletzt (letzte Zahl vom 20.03.) auf über 1.700 Fälle, was die chinesische Regierung nach einem Spitzenwert von 3.600 Neuinfektionen am 15.03. und dem damit fast höchsten Wert seit dem erstmaligen Corona-Ausbruch im Februar 2020 sofort mit neuen scharfen Lockdown-Verfügungen in landesweit fast allen chinesischen Provinzen und damit aktuell über 70 Großstädten beantwortete.
 Es liegt jedoch der begründete Verdacht nahe, dass selbst diese offiziell vermeldeten Zahlen des erneuten Infektionswellenausbruchs in China derzeit politisch extrem geschönt sein dürften, gab doch das direkt benachbarte Hongkong selbst in seiner Zwergstaatengröße seit Anfang März in der Spitze einen Anstieg auf bis zu 80.000 (!) Tagesneuinfektionen (03.03.) bekannt, die auch bis zum 21.03. immer noch ein beträchtlich hohes Niveau von rd. 14.000 aufwiesen.
Es liegt jedoch der begründete Verdacht nahe, dass selbst diese offiziell vermeldeten Zahlen des erneuten Infektionswellenausbruchs in China derzeit politisch extrem geschönt sein dürften, gab doch das direkt benachbarte Hongkong selbst in seiner Zwergstaatengröße seit Anfang März in der Spitze einen Anstieg auf bis zu 80.000 (!) Tagesneuinfektionen (03.03.) bekannt, die auch bis zum 21.03. immer noch ein beträchtlich hohes Niveau von rd. 14.000 aufwiesen.
2) Die seit Februar weltweit und gerade auch in Europa zunehmende Ausbreitung des Covid 19 Omikron-Varianten-Subtyps BA.2, die im Gegensatz zur zuvor international geläufigeren Variante BA.1 nicht nur potenziell deutlich über deren ansonsten lediglich grippeähnliche Symptomatik hinausgeht (nämlich ergänzt noch vor allem durch mögliche weitere Lungen- und Margen/Darm-Infektionen), sondern infolge deren außerdem deutlich höherer Ansteckungsinzidenz z.B. in Deutschland nach jüngsten Angaben des Robert Koch-Instituts (RKI) bereits 62 % aller Omikron- (= damit nahezu aller gesamten) Corona-Neuinfektionen ausmachte, verglichen mit noch unter 50 % in der Woche zuvor.
3) Die seit 15.03. von PFIZER (US7170811035) und BIONTECH gemeinschaftlich publizierte Ankündigung, man werde nun basierend auf sehr positiven Auswertungsergebnissen der Wirksamkeit einer Zweit-Booster-, d.h. Vierfach-Impfung von aktuell rd. 1,1 Mio. Empfängern von COMIRNATY in Israel im Alter von über 60 Jahren nun ebenfalls in den USA bei der Gesundheitsbehörde FDA die Zulassung ihres Vakzins für Viertimpfungen von über 65-Jährigen beantragen.
Bislang ist selbst für diese erhöhte Corona-Altersrisikogruppe, aber sogar auch bereits für Jugendliche ab einem Alter von 12 Jahren in den USA maximal eine Booster-Impfung mit COMIRNATY durch die FDA zugelassen, wobei diese derzeit frühestens 5 Monate nach Verabreichung der Zweitimpfung erfolgen darf.
China-Spekulation nahezu gegenstandslos, Omikron-Anpassung und Zweit-Boosterung aber nicht
Nach eingehenden Recherchen zu all diesen 3 genannten, zuletzt für die BioNTech-Aktie offenkundig allesamt kurstreibenden Begleitumständen kommen wir derzeit zu folgenden und dabei durchaus differenzierten analytischen Einschätzungen:
1) Die vermehrte Hypothese gleich diverser Finanzanalyse- und -Medienplattformen, der Ausbruch der erneuten Corona-Infektionswelle in China nähre die Wahrscheinlichkeit einer kurzfristig nun auch möglichen Zulassung von COMIRNATY im Reich der Mitte und könnte damit möglicherweise vielleicht sogar ein weiteres „Milliarden-Umsatzpotenzial“ eröffnen, erachten wir zum gegenwärtigen Zeitpunkt als nahezu gegenstandslos und erst Recht im genannten „denkbaren“ Umsatzvolumen als völlig utopisch.
Denn obwohl COMIRNATY bereits seit Januar bzw. Februar 2021 im Rahmen der dort laufenden Corona-Impfprogramme die Import- und Einsatzgenehmigungen in Chinas unmittelbar angrenzenden Staaten bzw. Verwaltungszonen Hongkong und Macau erhalten hat und BioNTech-CEO Ugur Sahin auch wegen der breiten Corona-Impfstoffkooperation mit dem führenden chinesischen Pharmakonzern FOSUN bereits im Mai 2021 seine starke Zuversicht äußerte, dass auch mit der dortigen COMIRNATY-Zulassung „spätestens im Juli 2021“ zu rechnen sei, ist diese Zulassung durch die chinesischen Gesundheitsbehörden selbst auch bis heute noch nicht erfolgt!
Gerade angesichts der absolut tragenden Rolle von FOSUN für die generelle chinesische Pharmaversorgung kommt dieser bisherigen Nicht-Zulassungsentscheidung von COMIRNATY unseres Erachtens daher eine absolute Signalwirkung zu und dürfte aus unserer Sicht wohl fast ausschließlich auf dem Politikum beruhen, dass China auf Veranlassung der Zentralregierung in den letzten Jahren fast ausschließlich einen strikt national-autarken Aufbau ihrer gesamten Pharmawirtschaft betrieben hat, so dass selbst auch alle bis dato zugelassenen 6 Corona-Impfstoffe in China durchweg allein aus nationaler Produktion stammen.
Da zudem COMIRNATY derzeit in China darüber hinaus gegen insgesamt nicht weniger als 22 weitere laufende klinische Testreihen in anderen Corona-Impfstoffen konkurriert (die systematische Übersicht zum aktuellen Status aller bisherigen Corona-Impfstoff-Projekte in China finden Sie hier) liegt die einzig weiterhin noch minimale Zulassungschance von COMIRNATY in China unseres Erachtens ausschließlich in ihrer (damit aber fraglos sehr volumens- und umsatzlimitierten) Chance, künftig ggfs. lediglich als ein denkbarer wirkungsverstärkender Kreuzimpfungs-Booster mit den anderen bisher zugelassenen 6 Vakzinen in Frage zu kommen, da diese allesamt eben NICHT auf dem mRNA-Verfahren beruhen und in den laufenden 24 Studienreihen COMIRNATY bzw. deren Wirkstoff BNT162b1 derzeit neben 3 weiteren ebenfalls nur einer der ganz wenigen ist, dem die mRNA-Technologie zugrunde liegt.
2) Die seit Ende Februar gerade in Europa aufgekommene rasante Ausbreitung des fraglos nochmals aggressiveren Omikron-Subtyps BA.2 nährt die Aussichten auf den tatsächlichen künftigen Bedarf und die Marktnachfrage nach einem speziell designten Omikron-Vakzin in der Tat in unseren Augen nun weit stärker, als wir das ursprünglich gemutmaßt hätten und zunächst offenbar selbst auch der Vorstandschef Ugur Sahin skeptisch bewertet hat (siehe seine ehemals offen vertretene Position in dieser Frage in unserer folgenden zurückliegende Analyse).
Auch wenn nach Einreichung aller aussagefähigen Studiendaten hierzu nach BioNTech-Ankündigung zunächst eine EMA-Zulassung dieses (vom Konzern bereits fertiggestellten und hypothetisch bereits ab Ende März auslieferbaren) Omikron-Vakzins wohl frühestens im Mai denkbar sein dürfte, könnte dies unseres Erachtens zeitlich immer noch rechtzeitig genug vor einem generellen Abklingen der Corona-Pandemie für künftig gesteigerte Weltmarkt-Absatzchancen des angepassten Omikron-Impfstoffs sorgen.
Allerdings dürfte dies für die bereits verbindlich abgeschlossenen 2022er Auslieferungsverträge im „klassischen“ COMIRNATY-Vakzin (hier prognostiziert Pfizer aktuell lediglich rd. 1,7 Mrd. (!) Auslieferungsdosen entgegen einer prinzipiell bestehenden Produktionskapazität von bis zu 4 Mrd. (!) Impfdosen) unseres Erachtens wohl kaum mehr, sondern sicher fast nur für künftige weitere Neuvertragsabschlüsse in 2022 und darüber hinaus gelten.
3) Eine künftige FDA-Zulassung von COMIRNATY zu Viertimpfungen in den USA von über 65jährigen Empfängern halten wir angesichts der beindruckend positiven Studiengrundlage aus Israel (völlige Wiederherstellung der Antikörperbildung einer selbst bis zu 6 Monate zurückliegenden Drittimpfung, Halbierung künftigen Infektionsrisikos gegenüber nur 3 Impfungen, Vervierfachung des Schutzes vor schweren Infektionsverläufen) schon nahezu für gesichert und könnte – anders als im Fall künftiger Impfangebote für Kinder unter 12 Jahren – a) wegen der gerade in den USA nachgewiesen erheblich größeren Impfbereitschaft älterer Menschen und b) da über 65-Jährige aktuell einen Anteil von immerhin rd. 17 % an der Gesamtbevölkerung der USA einnehmen, für BioNTech unseres Erachtens in der Tat damit durchaus für einen nennenswerten Zusatzertrag sorgen (gerade auch, wenn weitere internationale Gesundheits-Behörden sich dann dieser FDA-Zulassungserweiterung anschließen würden).
Kurzfristig Hochstufung auf SPEKULATIV HALTEN – Unterstützung bleibt aber sehr fragil
Wir sind daher - dies als zusammenfassendes FAZIT - schon der Auffassung, dass abgesehen von der „China-Frage“ die beiden übrigen genannten, sicher grundsätzlich als substanzieller einzustufenden weiteren Impulsfaktoren schon einiges weiteres Ertragspotenzial für BioNTech in sich bergen können.
 Trotz ihres nach wie vor von uns als äußerst anspruchsvoll erachteten KGVs (2024e) von fast 20 – schließlich dürfte der Konzern nach jeglichem Analystenkonsens ab 2025 erst einmal wieder deutlich in die „Corona-freie“ operative Verlustzone abtauchen – stufen wir die Aktie daher zumindest vorübergehend nun erst einmal wieder von VERKAUFEN auf SPEKULATIV HALTENSWERT hoch.
Trotz ihres nach wie vor von uns als äußerst anspruchsvoll erachteten KGVs (2024e) von fast 20 – schließlich dürfte der Konzern nach jeglichem Analystenkonsens ab 2025 erst einmal wieder deutlich in die „Corona-freie“ operative Verlustzone abtauchen – stufen wir die Aktie daher zumindest vorübergehend nun erst einmal wieder von VERKAUFEN auf SPEKULATIV HALTENSWERT hoch.
Auf eine künftige erneute klare Unterstützungsverletzung mit einer Unterschreitung von ca. 135 USD – was auch durchaus bereits im Falle einer enttäuschenden Konzernergebnis-/Ausblicks-Präsentation am 30.03. der Fall sein könnte – werden wir aus heutiger Sicht jedoch sofort wieder mit der Abgabe einer erneuten Verkaufsempfehlung für die BioNTech-Aktie reagieren.
Chart: BIONTECH (in US-Dollar)
BioNTech auf TradingView
23.03.2022 - Matthias Reiner
Auf Twitter teilen Auf Facebook teilen
Informiert bleiben - Wenn Sie bei weiteren Nachrichten und Analysen zu einem in diesem Artikel genannten Wert oder Unternehmen informiert werden möchten, können Sie unsere kostenfreie Aktien-Watchlist nutzen.
Folgende Artikel könnten Sie auch interessieren
Ihre Bewertung, Kommentar oder Frage an den Redakteur
Haftungsausschluss - Die EMH News AG übernimmt keine Haftung für die Richtigkeit der Empfehlungen sowie für Produktbeschreibungen, Preisangaben, Druckfehler und technische Änderungen. (Ausführlicher Disclaimer)






 01.10.2025
01.10.2025
 26.09.2025
26.09.2025
 22.09.2025
22.09.2025
 14.09.2025
14.09.2025