Valneva: Spekulativ halten – Drohende Anpassung des VLA2001-Abkommens mit der EU, jedoch beste Chikungunya-Impfstoffperspektiven
VLA2001-Zulassung zwar weiterhin plausibel, dennoch Prognosekorrektur wahrscheinlich

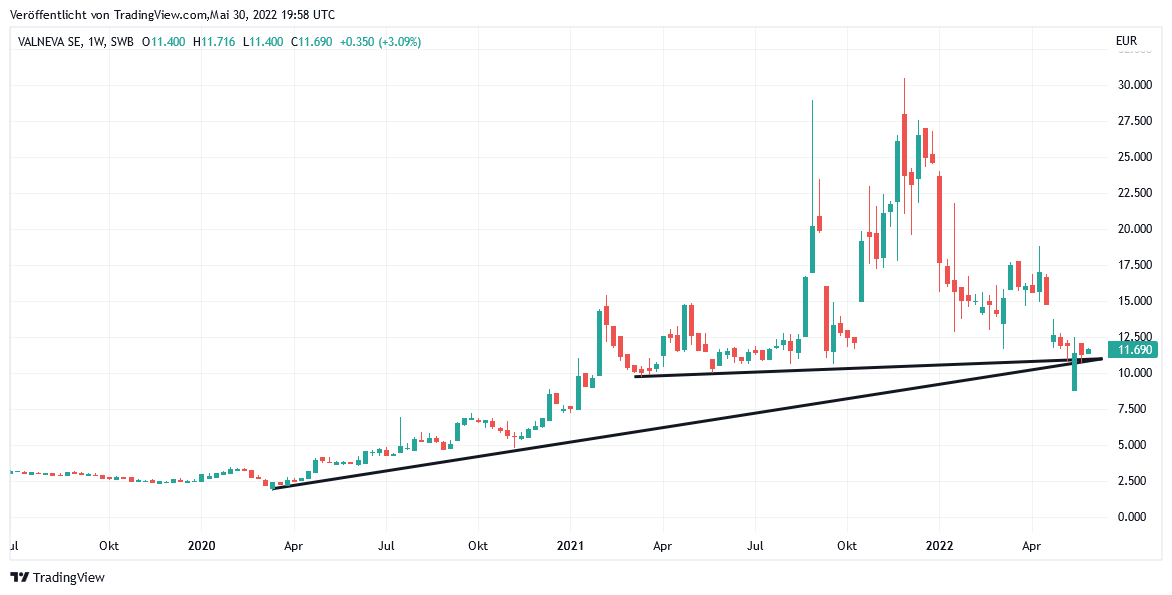
Auch weiterhin kämpft die Aktie der französischen VALNEVA, des potenziell weltweit ersten Herstellers eines Corona-Ganzkörper-Totimpfstoff-Vakzins (Substanz VLA2001), mühsam um die Behauptung ihrer alles entscheidenden Doppel-Unterstützung bei rd. 11 EUR, wo sowohl der steile Aufwärtstrend seit März 2020 wie auch der nur noch sehr flache seit März 2021 momentan exakt zusammenlaufen.
Zuvor war die Aktie von VALNEVA (FR0004056851) am 16.05. infolge der bekanntgegebenen Absichtserklärung der EU, das mit Valneva abgeschlossene Lieferabkommen über maximal 60 Mio. Impfdosen (davon Festbestellung von 24,3 Mio. Impfdosen für 2022, siehe auch hier) wegen der bis 30.04. durch die Arzneimittelzulassungsbehörde EMA ausgebliebenen Impfstoffzulassung von VLA2001 künftig gegebenenfalls rundweg aufzukündigen, unter massiver Unterschreitung dieser relevantesten Unterstützung von 11 EUR in der Spitze zwar schlagartig um – 27 % auf nur noch 8,80 EUR kollabiert.
 Ebenso schnell fing sich die Aktie jedoch anschließend wieder auf ihren derzeitigen Stand von 11,83 EUR, was nicht etwa nur der sofortigen Anschlusserklärung der EU-Kommission zuzuschreiben war, trotz dieser fallweise künftig kompletten Vertragsaufkündigung könne dieser dennoch unter der Maßgabe grundsätzlich aufrecht erhalten werden, dass Valneva bis spätestens bis zum 13.06. (= 30 Tage nach Erstellung der Absichtserklärung durch die EU) entweder eine offizielle Notfallzulassung von VLA2001 durch die EMA erwirkt oder andernfalls mit der EU-Kommission eine für alle Seiten akzeptable Transparenz zur Datenlage des bisherigen Zulassungs-Prozessstadiums oder andernfalls eine Modifikation der bisherigen Vertragsgestaltung herbeiführt.
Ebenso schnell fing sich die Aktie jedoch anschließend wieder auf ihren derzeitigen Stand von 11,83 EUR, was nicht etwa nur der sofortigen Anschlusserklärung der EU-Kommission zuzuschreiben war, trotz dieser fallweise künftig kompletten Vertragsaufkündigung könne dieser dennoch unter der Maßgabe grundsätzlich aufrecht erhalten werden, dass Valneva bis spätestens bis zum 13.06. (= 30 Tage nach Erstellung der Absichtserklärung durch die EU) entweder eine offizielle Notfallzulassung von VLA2001 durch die EMA erwirkt oder andernfalls mit der EU-Kommission eine für alle Seiten akzeptable Transparenz zur Datenlage des bisherigen Zulassungs-Prozessstadiums oder andernfalls eine Modifikation der bisherigen Vertragsgestaltung herbeiführt.
Den weiteren entscheidenden Impuls für die erneute Überwindung der kritischen Unterstützungsmarke von 11 EUR erhielt die Valneva-Aktie jedoch kurz darauf am 19.05., nachdem die EMA an diesem Tag nach der zum 25.04. unter anderem noch nachgeforderten Begründung ihrer Zulassungsantragsstellung für VLA2001 (siehe hierzu unsere letzte ausführliche Aktienanalyse), die Valneva daraufhin auch unverzüglich am 02.05. einreichte, den von Valneva gestellten Zulassungsantrag nun grundsätzlich genehmigte.
Das daraufhin durch den Vorstand von Valneva unter Leitung ihres CEOs Thomas Lingelbach abgegebene Statement, dass man nach dieser Zulassungsantragsgenehmigung damit nun auch der endgültigen VLA2001-Zulassung ein deutliches Stück näher gekommen und hiermit nun noch im Juni zu rechnen sei, teilen wir voll und ganz, da diese Einschätzung ebenfalls auch komplett auf einer Linie mit den ergänzenden Aussagen eines EMA-Sprechers liegt, dass in der mit Zulassungsantragsgenehmigung nun formell (und nicht mehr nur rollierend, d.h. ohne konkreten Zeitrahmen) verfolgten Zulassungsprüfung „mittlerweile bereits ein beträchtlicher Teil der von Valneva eingereichten Daten ausgewertet worden sei, so dass die EMA das weitere Prüfungsverfahren nun nach einem beschleunigten Zeitplan“ abwickeln könne.
Erhöhtes Risiko künftiger EU-Vertragsanpassung für VLA2001
Hiermit bleibt natürlich vorerst grundsätzlich auch weiterhin völlig offen, ob – wie durch den Valneva-Vorstand gemutmaßt und von uns auch angesichts der schon am 14.04. erfolgten Zulassung durch die britische Gesundheitsbehörde MHRA wie auch sogar die anschließende globale Zulassungsempfehlung der WHO durchaus für plausibel gehalten – die VLA2001-Zulassungserteilung der EMA künftig überhaupt erfolgen und dies auch noch bis zum nächsten ordentlichen Sitzungstermin des EMA-Prüfungsausschusses CHMP vom 20. – 23.06. der Fall sein wird.
Wenn jedoch diese Zulassung tatsächlich erfolgen sollte, wovon wir derzeit mit hoher Wahrscheinlichkeit ausgehen, so dürfte dies jedoch (außer im derzeit völlig ungeklärten Fall einer erheblichen EMA-Verfahrensbeschleunigung unter Ansetzung eines vorzeitigen außerordentlichen CHMP-Beratungstermins) fast sicher zu spät sein, um damit zumindest der einen Alternativforderung der EU-Kommission, die VLA 2001-Zulassung müsse bis zum 13.06. erfolgt sein, um eine Liefervertragsaufkündigung definitiv abzuwenden, gerecht zu werden.
 Da aber jedoch natürlich auch die EU-Kommission fraglos in ständigem Austausch mit der EMA steht und demzufolge auch selbst bestens über die Sitzungstermine der CHMP und somit die (Un-) Wahrscheinlichkeit einer VLA 2001-Zulassung bis 13.06. informiert sein wird, rechnen wir selbst in diesem Fall der Nichtzulassung bis 13.06. nun folgerichtig damit, dass dies die EU-Kommission in keinem Fall zum Anlass für eine vollständige Aufkündigung des Lieferabkommens mit Valneva nehmen dürfte (diese ansonsten dann wohl nur taktisch sehr früh auf den 13.05. terminierte Kündigungs-Absichtserklärung wäre dann aus unserer Sicht doch zumindest moralisch sehr zu hinterfragen).
Da aber jedoch natürlich auch die EU-Kommission fraglos in ständigem Austausch mit der EMA steht und demzufolge auch selbst bestens über die Sitzungstermine der CHMP und somit die (Un-) Wahrscheinlichkeit einer VLA 2001-Zulassung bis 13.06. informiert sein wird, rechnen wir selbst in diesem Fall der Nichtzulassung bis 13.06. nun folgerichtig damit, dass dies die EU-Kommission in keinem Fall zum Anlass für eine vollständige Aufkündigung des Lieferabkommens mit Valneva nehmen dürfte (diese ansonsten dann wohl nur taktisch sehr früh auf den 13.05. terminierte Kündigungs-Absichtserklärung wäre dann aus unserer Sicht doch zumindest moralisch sehr zu hinterfragen).
Umso wahrscheinlicher dürfte die EU-Kommission in diesem Fall dann aber dafür wohl von der 2. Alternative für den Fortbestand des Lieferabkommens Gebrauch machen, nämlich diesen Vertrag – auch angesichts der ja aus heutiger Sicht immer geringer werdenden allgemeinen Corona-Gefährdungslage – mit Valneva künftig entscheidend nachzuverhandeln oder gar auch komplett neu zu gestalten.
Auch wenn, um dies tunlichst zu vermeiden, der Valneva-Vorstand bereits jetzt in einen ständigen intensiven Dialog mit der EU-Kommission und einzelnen (nach Vorstandsangaben zumeist an ihrem Impfstoff sehr interessierten) EU-Ländern eingetreten ist, könnte eine solche Vertragsabänderung nach bereits getätigten Aussagen von CEO Lingelbach künftig aber dennoch eine Korrektur der bisherigen Ergebnisziele für 2022 (und darüber hinaus) unvermeidlich machen, was bisher für 2022 in einer Umsatzprognosespanne von 430 – 590 Mio. EUR (davon 350 – 500 Mio. EUR allein in ihrem Corona-Vakzin) bestand.
Würde also ein solcher EU-Vertragsnachverhandlungs- und damit Ergebniskorrektur-Anlass im Fall einer bis 13.06. ausbleibenden VLA2001-Zulassung eintreten, wofür wir derzeit durchaus eine erhöhtes Risiko sehen, so hätte dies am Tag einer solchen Meldung zweifellos wiederum einen deutlichen Aktienkursdruck unter erneuter Unterschreitung von 11 EUR zur Folge, weshalb gerade KONSERVATIV(ER) eingestellte Investoren unseres Erachtens derzeit vorsorglich durchaus einen Ausstieg aus der Aktie in Erwägung ziehen sollten.
Auf der anderen Seite besteht jedoch auch weiterhin natürlich prinzipiell noch immer das (jedoch sicher weniger wahrscheinliche) Szenario, dass der VLA2001-Liefervertrag mit der EU für Valneva künftig zumindest fast ohne Abstriche aufrecht erhalten bleibt, was nach dem zurückliegenden „Hickhack“ mit der EMA zur Einholung ihrer Zulassungsgenehmigung für Valneva sicher noch der nahezu denkbar beste Ausgang wäre.
Beste Perspektiven durch aktuelles Weltmonopol im Chikungunya-Vakzin VLA1553
Denn gerade in diesem positiven Falle würde auch dem zweiten, perspektivisch ebenfalls klar für Valneva sprechenden Umstand von den Anlegern (psychologisch) sicher zusätzlich nochmals eine umso stärkere Aufmerksamkeit geschenkt, dass – wie schon im Rahmen der Quartalszahlenvorlage am 05. Mai angekündigt und schließlich vor 4 Tagen erweitert bestätigt – nach sehr erfolgreichem Abschluss ihrer entscheidenden Phase 3-Studie zum Impfwirkstoff VLA1553 gegen das Chikungunya-Stechmücken-Virus im März (96,3%ige virusneutralisierende Antikörperimmunisierung der insgesamt 408 Probanden noch 6 Monate nach Erhalt einer einzigen Erstimpfung) auch ein anschließender Test anhand dreier willkürlich selektierter Produktionschargen (sog. Lot-to-Lot-Tests) exakt die gleichen hoch überzeugenden Ergebnisse erbrachte, weshalb Valneva im „späteren“ Jahresverlauf nun ebenfalls zunächst bei der FDA den Zulassungsantrag für VLA1553 stellen will.
Wie perspektivisch hoch relevant eine solche Zulassung für Valneva wäre (und diese neben ihren Covid 19-Aktivitäten wie auch ihren bereits marktgängigen Vakzinen IXIARO / gegen Japanische Enzephalitis und DUKORAL / gegen Cholera und deren auslösende Coli-Bakterien auch schon jetzt in einen klaren Diversifikations-Vorsprung z.B. gegen BIONTECH (US09075V1026) versetzt) wird schon allein dadurch überdeutlich, dass dieses Virus infolge seines primären Vorkommens in feucht-tropischen Gebieten tourismusbedingt mittlerweile in über 100 (!) Ländern der Erde verbreitet ist, nach Marktforschungserhebungen die in 2020 weltweit bereits 1,2 Mrd. USD betragenden Medikamenten-Therapiekosten bis 2027 weiter auf ca. 2,0 Mrd. USD hochschnellen dürften, Valneva demzufolge ihr Umsatzpotenzial in VLA1553 langfristig auf über 500 Mio. USD jährlich taxiert, und außerdem der Konzern derzeit auch sogar ein reiner Weltmonopolist in der Herstellung eines solchen Vakzins ist, nachdem MODERNA (US60770K1079) ihrerseits die mögliche Einbringung ihres gleichfalls entwickelten mRNA-Chikungunya-Wirkstoffs in die 2. klinische Testphase im November 2021 nun kurzerhand völlig auf Eis legte.
Mit jeglicher Berechtigung hat die FDA daher VLA1553 auch bereits grundsätzlich einen beschleunigten sog. Fast Track-Zulassungsstatus zuerkannt, dem sich zuletzt sogar nun auch bereits die EMA angeschlossen hat.
 Angesichts dieses perspektivisch weiteren hoch relevanten Zusatzpotenzials von VALNEVA stufen wir die Aktie trotz des künftig ungewissen Fortbestands bzw. Ertragsvolumens des EU-Lieferabkommens für VLA2001 basierend auf ihrem aktuell u.E. immer noch deutlich berechenbareren KGV (2024e) von rd. 7 im Vergleich zu BIONTECH (KGV 2024e von 13) als grundsätzlich wesentlich attraktiver ein und bekräftigen daher erneut unser Votum, allerdings nur an betont SPEKULATIV eingestellte Anleger, die Aktie längerfristig auch weiterhin zu HALTEN.
Angesichts dieses perspektivisch weiteren hoch relevanten Zusatzpotenzials von VALNEVA stufen wir die Aktie trotz des künftig ungewissen Fortbestands bzw. Ertragsvolumens des EU-Lieferabkommens für VLA2001 basierend auf ihrem aktuell u.E. immer noch deutlich berechenbareren KGV (2024e) von rd. 7 im Vergleich zu BIONTECH (KGV 2024e von 13) als grundsätzlich wesentlich attraktiver ein und bekräftigen daher erneut unser Votum, allerdings nur an betont SPEKULATIV eingestellte Anleger, die Aktie längerfristig auch weiterhin zu HALTEN.
Chart: VALNEVA
Valneva auf TradingView
30.05.2022 - Matthias Reiner
Auf Twitter teilen Auf Facebook teilen
Informiert bleiben - Wenn Sie bei weiteren Nachrichten und Analysen zu einem in diesem Artikel genannten Wert oder Unternehmen informiert werden möchten, können Sie unsere kostenfreie Aktien-Watchlist nutzen.
Folgende Artikel könnten Sie auch interessieren
Ihre Bewertung, Kommentar oder Frage an den Redakteur
Bewertungen, Kommentare und Fragen an den Redakteur
-
-
02.06.2022 09:16:19 Uhr
Haftungsausschluss - Die EMH News AG übernimmt keine Haftung für die Richtigkeit der Empfehlungen sowie für Produktbeschreibungen, Preisangaben, Druckfehler und technische Änderungen. (Ausführlicher Disclaimer)






 26.08.2025
26.08.2025
 14.09.2024
14.09.2024
 14.11.2023
14.11.2023
 14.11.2023
14.11.2023