BioNTech: Allein charttechnisch spekulativ haltenswert – Operative Gewinnrisiken jedoch unzureichend reflektiert
Ergebniseinbrüche ab 2023 weiterhin viel zu stark ausgeblendet
In der zurückliegenden Woche verzeichnete die Aktie von BIONTECH trotz vordergründig mehrerer positiver Fundamentalnachrichten, wie ersten Teilstudienergebnissen einer signifikanten Booster-Effizienz von COMIRNATY bei 5 – 11jährigen Kindern gegen den SARSCov2-Corona-Basistyp und auch dessen Omikron-Mutante, des Abschlusses eines langfristigen COMIRNATY-Notfall-Lieferabkommens mit der deutschen Regierung, einer neuen Kooperationsvereinbarung mit MATINAS BIOPHARMA zur künftigen Nutzung ihrer besonders fortschrittlichen Lagerungs- und Verabreichungstechnologien von potenziellen mRNA-Vakzinen wie auch erster ermutigender Phase 1 / 2-Resultate des Krebstumore bekämpfenden CAR-T-Zell-Vakzinkandidaten BNT211 dennoch lediglich einen moderaten Kursaufschlag von + 2,8 % (in US-Dollar).
Dass sich die Aktie von BIONTECH (US09075V1026) auf die oben genannte vermeintlich positive Nachrichtenfülle hin in der letzten Woche nicht stärker befestigte, ist aus unserer Sicht auch weiterhin vollauf nachvollziehbar, da auch diesen weiteren Projektmeldungen von BioNTech unseres Erachtens derzeit noch keinerlei abseh- und einschätzbare Zussatzgewinnbeiträge und selbst wenn, dann sicherlich nur auf eine lange und zudem auch betraglich sehr begrenzte Sicht beizumessen sind.
Zunächst nehmen wir die Mitteilung positiver Phase 2/3-Studienergebnisse zur Wirkungsverstärkung eines COMIRNATY-Erstboosters, d.h. einer dritten Impfung von Kindern im Alter von 5-11 Jahren unter die Lupe.
So macht nach vielfacher Kritik medizinischer Experten der von BioNTech vorgelegte
 Studienergebnis-Umfang aus gerade einmal 140 ausgewerteten Blutseren (im Fall der Omikron-Testung hieraus sogar nur eine Subanalyse von lediglich 30 Seren) - und dies bei einem derzeit bei BioNTech weltweit bei über 10.000 (!) Kindern im Alter von 6 Monaten – 11 Jahren liegenden Probandenstamm - allein schon einen so verschwindend geringen und damit statistisch kaum aussagefähigen Teil aus dieser Grundgesamtheit an Probanden aus, dass schon allein hierauf die von BioNTech in den nächsten Tagen zur Notfallzulassung (EUA) angefragte US-amerikanische FDA selbst trotz jeglicher vorgelegter ermutigender Auswertungsergebnisse dieser Klein(st)-Studien (bei 30 untersuchten Seren Ver-36-Fachung der Antikörperbildung gegen alle Omikron-Varianten nach Booster mindestens 6 Monate nach Erhalt der Zweitimpfung; außerdem bei 140 untersuchten Seren Ver-6-Fachung der Antikörperbildung gegen das SARSCov2-Corona-Basisvirus 1 Monat nach Erhalt des Boosters) noch erheblich umfangreichere und signifikantere Dateneinreichungen verlangen dürfte, bevor für einen solchen Erstbooster an Kindern von 5 – 11 Jahren eine abschließende Zulassung erteilt werden dürfte.
Studienergebnis-Umfang aus gerade einmal 140 ausgewerteten Blutseren (im Fall der Omikron-Testung hieraus sogar nur eine Subanalyse von lediglich 30 Seren) - und dies bei einem derzeit bei BioNTech weltweit bei über 10.000 (!) Kindern im Alter von 6 Monaten – 11 Jahren liegenden Probandenstamm - allein schon einen so verschwindend geringen und damit statistisch kaum aussagefähigen Teil aus dieser Grundgesamtheit an Probanden aus, dass schon allein hierauf die von BioNTech in den nächsten Tagen zur Notfallzulassung (EUA) angefragte US-amerikanische FDA selbst trotz jeglicher vorgelegter ermutigender Auswertungsergebnisse dieser Klein(st)-Studien (bei 30 untersuchten Seren Ver-36-Fachung der Antikörperbildung gegen alle Omikron-Varianten nach Booster mindestens 6 Monate nach Erhalt der Zweitimpfung; außerdem bei 140 untersuchten Seren Ver-6-Fachung der Antikörperbildung gegen das SARSCov2-Corona-Basisvirus 1 Monat nach Erhalt des Boosters) noch erheblich umfangreichere und signifikantere Dateneinreichungen verlangen dürfte, bevor für einen solchen Erstbooster an Kindern von 5 – 11 Jahren eine abschließende Zulassung erteilt werden dürfte.
Zusatzgewinn-Potenziale durch Booster-Zulassung für 5-11jährige Kinder begrenzt
Darüber hinaus ist jedoch nach jeglichen soziodemographischen Umfragen die Bereitschaft von Eltern, ihre Kinder gegen Corona impfen, geschweige denn nun künftig auch noch boostern zu lassen, weiterhin gerade in den USA dermaßen gering ausgeprägt (siehe hierzu z.B. auch unsere zurückliegende Analyse vom 05.02.), dass auch schon dies die effektive künftige Nachfrage und entsprechend sicher auch den Absatz von COMIRNATY für Kinder dieser Altersgruppe künftig zumindest in den USA weiterhin stark begrenzen dürfte.
Auch generell ist überdies nach einer am 11.04. neu veröffentlichten Umfrage von IBD/TIPP die allgemeine Corona-Impfbereitschaft in den USA völlig korrespondierend mit den dort seit 3 Monate rapide rückläufigen Neuinfektionszahlen auf einem neuen absoluten Tiefpunkt angekommen, der mittlerweile selbst auch die grundsätzlich impfbereiteste Gruppe der über 50-Jährigen erfasst (von denen sich aktuell lediglich rd. 11 % (!) bereit erklären, die in den USA seit 29.3. angebotene Zweit-Boosterung mit COMIRNATY oder auch SPIKEVAX von MODERNA (US60770K1079) in Anspruch nehmen zu wollen).
Alle weiteren o.g. Projektmeldungen von BioNTech der letzten Woche weisen aus unserer Sicht für den Konzern ebenso im besten Falle nur sehr langfristig gegebene, aber in keinem Fall schon jetzt hinreichend absehbare nennenswerte Ergebnisbeitrags-Wahrscheinlichkeiten auf, als dass hierdurch in der letzten Woche ein stärkerer Aktiensprung gerechtfertigt gewesen wäre.
Verbesserte Lagerungs- und Verabreichungslösungen durch Matinas BioPharma?
So dient das am 11.04. mit MATINAS BIOPHARMA (US5768101058) von BioNTech geschlossene Abkommen, gegen eine Anfangszahlung von 2,75 Mio. USD und künftige Forschungsunterstützungen in den kommenden Jahren gegebenenfalls einen derzeit auch verhandelten exklusiven Lizenzzugang zur weltführend innovativen Entwicklung ihrer lipiden Nanokristall-Plattform zu erhalten allein dazu, den aktuell gravierendsten pharmakologischen Schwachpunkt aller mRNA-Wirkstoffe (nicht nur bei BioNTech) auszuschalten, nämlich dass deren klassische, nicht-kristalline Lipidstrukturen ihre Beständigkeit und damit auch gesicherte Intoxizität (!) nur bei dauerhaft tiefsten Lagerungstemperaturen von ca. – 60 bis – 90 Grad besitzen und außerdem deshalb bislang ausschließlich als Injektionen und nicht alternativ auch z.B. oral oder nasal verabreicht werden können.
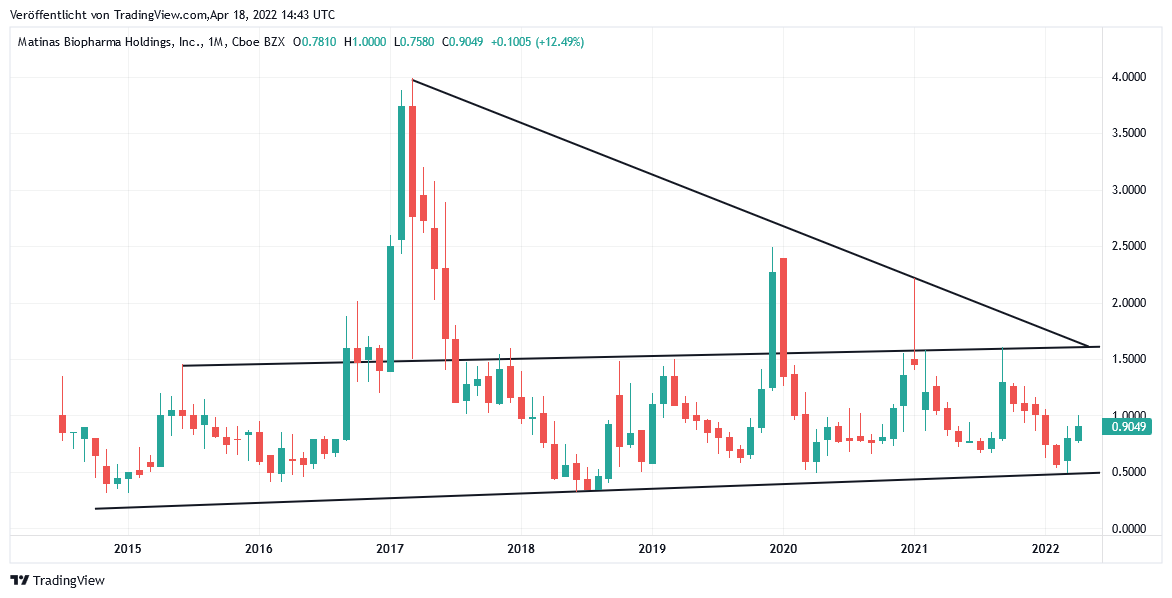
Ob dieser entscheidende Schwachpunkt, den im Übrigen konkurrierende Tot-Impfstoffe wie z.B. VLA2001 von VALNEVA (FR0004056851) von Vornherein gerade NICHT aufweisen, durch das jetzige Abkommen von Matinas mit der Nanokristall-Forschungsunterstützung von BioNTech künftig jedoch entscheidend behoben und damit auch ggfs. auf jegliche weitere anderen mRNA-Wirkstoffe ihrer Pipeline ausgeweitet werden kann, steht derzeit jedoch noch völlig in den Sternen, was auch der selbst nach dieser Meldung weiterhin nun schon seit 2014 völlig unspektakulär hoch volatil seitwärts tendierende Chart der Aktie von Matinas untrüglich signalisiert.
Chart: MATINAS BIOPHARMA (in US-Dollar)
Matinas BioPharma auf TradingView
Ferner ist es natürlich als ermutigend zu werten, dass nach ersten vorläufigen, am 11.04. publizierten Frühergebnissen einer Phase 1 / 2-Studie bei 16 Patientenempfängern des mRNA-Wirkstoffs BNT211 bereits nach 10-17 Tagen eine starke Vermehrung ihrer körpereigenen Tumorbekämpfungszellen (sog. CAR-T-Zellen) in ihren bestehenden Hoden-, Eierstock-, Gebärmutter-, Bronchial- und Magen-Krebsindikationsgebieten festgestellt wurde. Jedoch dürfte dies auch weiterhin grundsätzlich nicht das Mindeste daran ändern, dass innerhalb der durchweg allesamt in präklinischen oder bestenfalls in Phase 1 / 2-Studien befindlichen insgesamt 19 weiteren mRNA-Krebswirkstoff-Kandidaten von BioNTech nach jüngsten Aussagen der Konzern-Mitgründerin Özlem Türeci oder auch des Aufsichtsratschefs Helmut Jeggle (siehe hier) BNT211 im Krebs-Segment der erste sein dürfte, der kaum früher als in ca. 4 – 5 Jahren seine Marktreife erhalten und damit dann auch überhaupt die ersten positiven Krebsforschungs-Gewinnbeiträge zum Konzerngewinn von BioNTech leisten dürfte.
Kapazitätsabkommen mit deutscher Regierung vorerst ohne größere Gewinnrelevanz
Und schließlich ist auch hinsichtlich der letzten relevanten Meldung von BioNTech am 08.04. des Abschlusses eines 5 Jahres-Rahmenvertrags mit der deutschen Bundesregierung zur künftigen Gewährleistung einer notfalls erforderlichen Auslieferbarkeit von jährlich mindestens 80 Mio. COMIRNATY-Impfdosen bis 2027 explizit klarzustellen, dass es sich hierbei eben nicht um eine bereits jetzt „potenziell milliardenschwere“ feste oder selbst auch nur optionale Liefervereinbarung (wie in einigen Medien fälschlich kolportiert) handelt, sondern allein um eine geschlossene Verpflichtung von BioNTech für den künftigen Fall jeglichen etwaigen weiteren Einsatzbedarfs von COMIRNATY, bis 2027 die jährliche rein technische Aufrechterhaltung von PRODUKTIONSKAPAZITÄTEN über mindestens 80 Mio. und im Falle des Abrufs dann auch in kürzester Zeit lieferbare Impfdosen zu gewährleisten.
Hierfür wird BioNTech, genau wie auch im Fall des im Volumen exakt gleich großen, aber nach 2jähriger Vazinentwicklungs-Probephase von 2024 – 2029 laufenden weiteren Abkommens der Bundesregierung mit dem Joint Venture von CUREVAC (NL0015436031) und GLAXOSMITHKLINE / GSK (GB0009252882) betraglich zunächst lediglich eine bislang in keiner Weise quantifizierte fixe Zahlung in Form einer Kapazitätsunterhaltungs-Entschädigung erhalten, womit allerdings natürlich derzeit nicht die allergeringste Impfstoff-Abnahmezusage einhergeht.
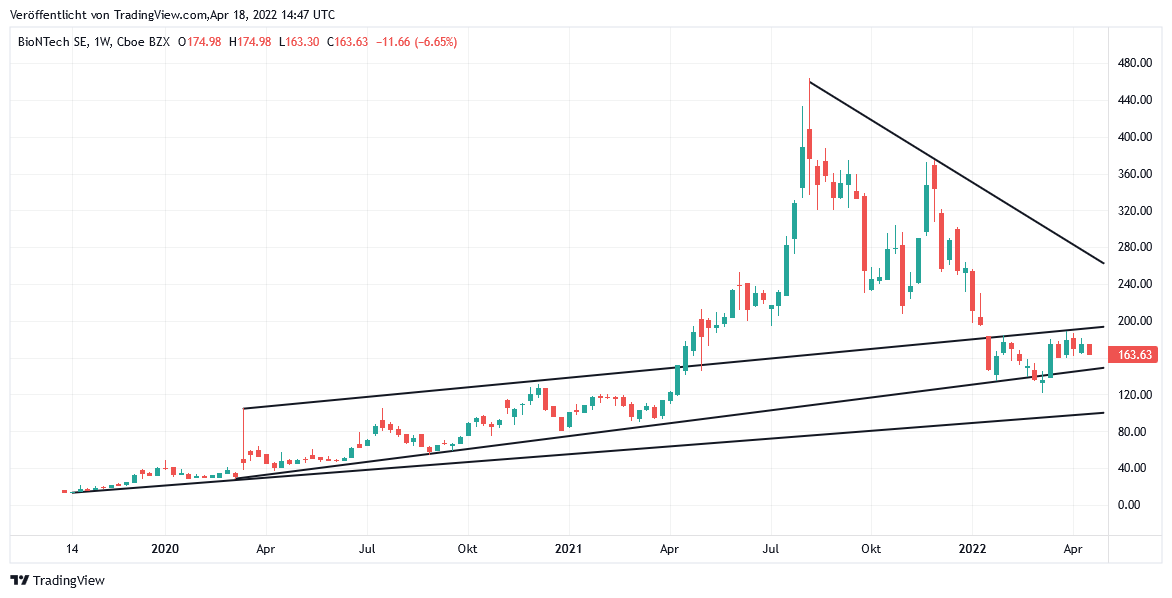
 Auch nach dieser weiteren Nachrichtenflut der letzten 10 Tage, die für uns jedoch erneut keinerlei Aufschlüsse über eine hierdurch mögliche Minderung des coronabedingt von 2022 – 2025 zweifellos massiv eintretenden Ergebniseinbruchs von BioNTech lieferte (Umsatz: ca. – 63 %, Nettogewinn: - 78 %) halten wir die Aktie mit einem aktuellen rechnerischen KGV (2025e) von rd. 20 weiterhin fundamental für klar überbewertet und stufen sie daher allein aus charttechnischer Sicht zumindest kurzfristig weiterhin als SPEKULATIV HALTENSWERT ein.
Auch nach dieser weiteren Nachrichtenflut der letzten 10 Tage, die für uns jedoch erneut keinerlei Aufschlüsse über eine hierdurch mögliche Minderung des coronabedingt von 2022 – 2025 zweifellos massiv eintretenden Ergebniseinbruchs von BioNTech lieferte (Umsatz: ca. – 63 %, Nettogewinn: - 78 %) halten wir die Aktie mit einem aktuellen rechnerischen KGV (2025e) von rd. 20 weiterhin fundamental für klar überbewertet und stufen sie daher allein aus charttechnischer Sicht zumindest kurzfristig weiterhin als SPEKULATIV HALTENSWERT ein.
Eine erneute nachhaltige Verletzung der kritischsten Unterstützungszone von derzeit ca. 140 – 150 USD würde jedoch wiederum sofort ein Verkaufssignal in der Aktie generieren und in diesem Falle ein charttechnisches Rückschlagspotenzial auf ein bewertungs- wie auch trendtechnisch unseres Erachtens vollauf angemessenes Aktienkursniveau von nur noch rd. 100 – 110 USD (= KGV (2025e) von rd. 13) eröffnen.
Chart: BIONTECH (in US-Dollar)
BioNTech auf TradingView
18.04.2022 - Matthias Reiner
Auf Twitter teilen Auf Facebook teilen
Informiert bleiben - Wenn Sie bei weiteren Nachrichten und Analysen zu einem in diesem Artikel genannten Wert oder Unternehmen informiert werden möchten, können Sie unsere kostenfreie Aktien-Watchlist nutzen.
Folgende Artikel könnten Sie auch interessieren
Ihre Bewertung, Kommentar oder Frage an den Redakteur
Bewertungen, Kommentare und Fragen an den Redakteur
-
-
19.04.2022 05:58:29 Uhr
Haftungsausschluss - Die EMH News AG übernimmt keine Haftung für die Richtigkeit der Empfehlungen sowie für Produktbeschreibungen, Preisangaben, Druckfehler und technische Änderungen. (Ausführlicher Disclaimer)






 01.10.2025
01.10.2025
 26.09.2025
26.09.2025
 22.09.2025
22.09.2025
 14.09.2025
14.09.2025